L’eau, si banale et abondante sur Terre, est pourtant une substance quasi unique : elle possède des propriétés chimiques et physiques très étonnantes et se comporte de manière bizarre. Glace, liquide ou vapeur d’eau : découvrez les mystères de l’eau.
Vous croyez tout savoir sur la molécule H2O ? De récentes études viennent pourtant de montrer que l’eau liquide peut coexister sous deux états différents ! Vous n’avez jamais vu une barre de fer flotter sur du fer fondu ? Les glaçons, eux, surnagent au-dessus de l’eau liquide ! Bref, l’eau est loin d’être une matière quelconque.
La glace est moins dense que l’eau liquide
Alors que la quasi totalité des matériaux sont plus denses à l’état solide qu’à l’état liquide, les icebergs flottent sur l’océan et les glaçons surnagent dans un verre. Habituellement, quand une substance gèle, ses molécules se rapprochent. Mais l’eau présente une anomalie : sa densité maximale est atteinte à 4 °C et commence à diminuer en-deçà. Cela signifie que, pour un même volume, il y a moins de molécules dans un glaçon que dans l’eau liquide : il est donc plus léger.
L’eau est présente dans la nature sous ses trois états : liquide, solide, gazeux
Il est facile d’observer dans la nature de la glace, de l’eau liquide et de la vapeur d’eau. En revanche, vous aurez peu de chance de trouver de la vapeur d’or ou de la neige carbonique — la forme solide du dioxyde de carbone (CO2) — en vous baladant dehors ! Cette étrange propriété vient notamment de la température de fusion particulièrement élevée de l’eau : l’oxygène seul s’évapore par exemple à -183 °C, mais les liaisons hydrogène entre les molécules d’eau obligent à fournir beaucoup plus d’énergie pour passer à l’état de vapeur.
L’eau chaude gèle plus vite que l’eau froide
Placez un bac à glaçons rempli d’eau chaude au congélateur et vos glaçons seront prêts plus rapidement qu’avec de l’eau froide. Ce curieux phénomène, nommé « effet Mpemba », aurait plusieurs explications. Il pourrait être dû à l’évaporation qui diminue la masse d’eau et consomme de la chaleur, ce qui favorise son refroidissement. L’eau chaude serait aussi moins sensible à l’effet de surfusion qui permet à un liquide de rester solide même lorsque sa température est passée sous son seuil de solidification. D’autres hypothèses s’appuient sur les transferts thermiques (les courants de convection seraient plus importants dans l’eau chaude) ou la modification des liaisons chimiques entre les molécules de l’eau (rétrécissement des liaisons covalentes entre les atomes d’oxygène et d’hydrogène).
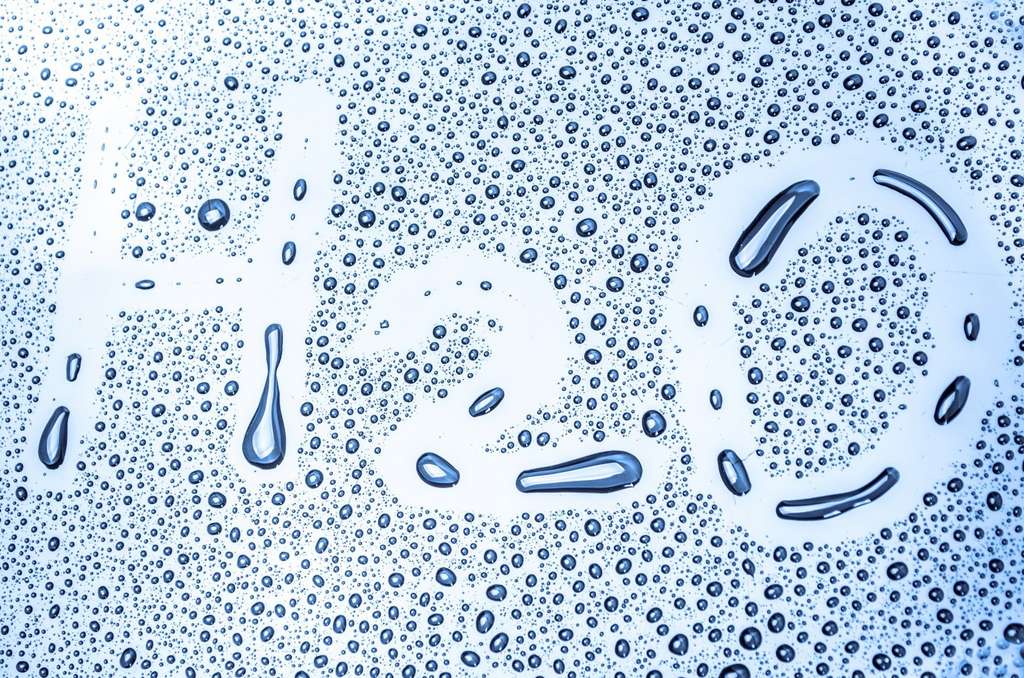
Il existe deux formes d’eau liquide
Dernièrement, plusieurs études ont suggéré que l’eau liquide coexiste en fait sous deux formes : l’une à faible densité, dans laquelle les molécules forment des nombreuses liaisons hydrogène avec leurs voisines, ce qui les tient à distance les unes des autres, et une autre de haute densité, où les molécules « s’entassent » les unes sur les autres et peuvent donc se rapprocher. S’il est relativement courant de trouver plusieurs formes de solides pour un même matériau, c’est beaucoup plus rare pour un liquide. Le seul cas connu à ce jour est l’hélium, dont sa forme liquide hélium II peut ramper le long des surfaces !
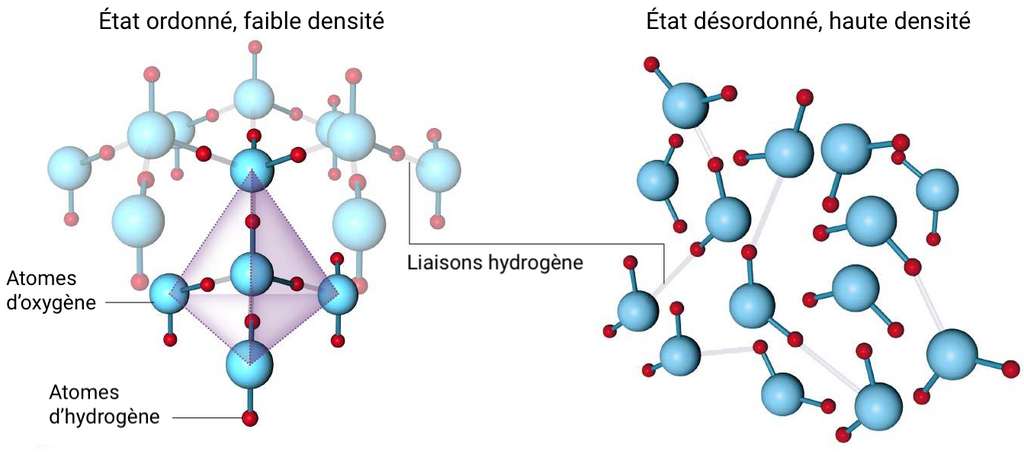
L’eau est un excellent solvant
Il suffit de regarder un morceau de sucre fondre dans son café ou du sel en poudre se dissoudre dans sa casserole pour s’en rendre compte : l’eau est un excellent solvant. Impossible à l’inverse de dissoudre du sel dans de l’huile ou du pétrole : il va rester solide au fond du récipient. Cette capacité de dissolution s’explique par la nature polaire de l’eau qui a tendance à attirer les molécules ioniques (avec des ions chargés positivement ou négativement). Lorsque l’on met par exemple du sel (NaCl) dans l’eau, les molécules d’eau vont dissocier les ions chlorure et les ions sodium ; il se forme une solution aqueuse Na+ + Cl-. De même, l’eau dissout facilement les autres molécules polaires comme les sucres ou l’éthanol.
L’eau peut être à la fois liquide et solide
Des chercheurs ont récemment démontré l’existence de « l’eau superionique », une eau semi-liquide et solide qui devient conductrice comme un métal. Dans des conditions très élevées de pression et de température, les liaisons hydrogène sont détruites, laissant les ions hydrogène circuler librement dans le réseau des cristallins des atomes d’oxygène, qui restent eux organisés comme s’ils étaient « figés ». L’eau peut également se présenter sous forme surfondue, où elle demeure liquide jusqu’à des températures de -48 °C avant de geler subitement en cas de contact avec une autre surface.
L’eau rétrécit en fondant
La grande majorité des substances occupe plus de place à l’état liquide — lorsque les molécules sont désordonnées — qu’à l’état solide — où les molécules ont une structure organisée. L’eau est un cas à part : elle occupe environ 10 % de volume en plus lorsqu’elle gèle. Cette bizarrerie nommée « anomalie dilatométrique » s’explique par la structure particulière de la molécule d’eau, où les liaisons hydrogène s’assemblent en réseau hexagonal, laissant beaucoup de place entre les molécules.
Source : 7 propriétés étranges de l’eau